Innehåll
- Dosering
- Rekommendationsrekommendationer
- Vanliga biverkningar
- Läkemedelsinteraktioner
- Kontraindikationer och överväganden
Harvoni godkändes den 10 oktober 2014 av U.S. Food and Drug Administration (FDA) för användning hos vuxna 18 år eller äldre med HCV-genotyp 1-infektion, inklusive de med cirros.
Harvoni är godkänt för användning hos tidigare obehandlade ("behandlingsnaiva") patienter, liksom patienter med delvis eller inget svar på tidigare HCV-behandling ("behandlingserfarna").
Harvoni är det första FDA-godkända HCV-läkemedlet som inte behöver tas med varken pegylerat interferon (peg-interferon) eller ribavirin (två läkemedel som traditionellt används för HCV-kombinationsbehandling, som båda hade höga toxicitetsprofiler).
Harvoni rapporteras ha en läkningstakt på mellan 94% och 99%, medan fas II-studier har rapporterat en botningsgrad på 100% hos patienter som saminfekterats med HIV och HCV.
Dosering
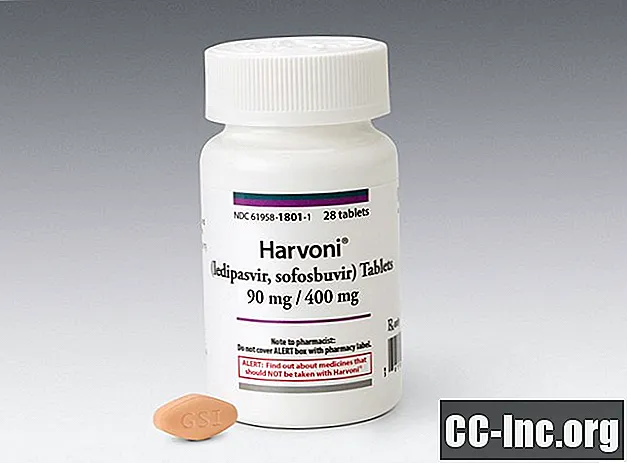
En tablett (90 mg / 400 mg) tas dagligen med eller utan mat. Harvoni-tabletter är diamantformade, ingefärgade och filmdragerade, med "GSI" präglade på ena sidan och "7985" på den andra.
Rekommendationsrekommendationer
Harvoni ordineras under en 12- till 24-veckors kurs enligt följande rekommendationer:
- Behandlingsnaiv med eller utan cirros: 12 veckor
- Behandlingserfaren utan cirros: 12 veckor
- Behandlingserfarenhet med cirros: 24 veckor
Dessutom kan en 8-veckors kurs övervägas för behandlingsnaiva patienter utan cirros som har en HCV-virusbelastning på under 6 miljoner kopior / ml.
Vanliga biverkningar
De vanligaste biverkningarna i samband med användning av Harvoni (förekommer hos 10% eller mindre av patienterna) är:
- Trötthet
- Huvudvärk
Andra möjliga biverkningar (under 10%) inkluderar illamående, diarré och sömnlöshet.
Läkemedelsinteraktioner
Följande bör också undvikas när du använder Harvoni:
- Rifampinbaserade läkemedel mot tuberkulos: Mycobutin, Rifater, Rifamate, Rimactane, Rifadin, Priftin
- Antikonvulsiva medel: Tegretol, Dilantin, Trileptal, fenobarbital
- Aptivus (tipranavir / ritonavir) som används vid HIV-antiretroviral behandling
- Johannesört
Kontraindikationer och överväganden
Det finns inga kontraindikationer för användning av Harvoni hos patienter med HCV-genotyp 1.
För patienter med hiv som använder läkemedlet tenofovir (inklusive Viread, Truvada, Atripla, Complera, Stribild) bör emellertid extra försiktighet iakttas vid övervakning av eventuella tenofovirassocierade biverkningar, särskilt nedsatt njurfunktion (njure).
Antacida ska tas separat 4 timmar före eller efter en Harvoni-dos, medan doser av protonpumpshämmare och H2-receptorhämmare (aka H2-blockerare) kan behöva minskas för att förhindra minskad ledipasvirabsorption.
Även om det inte finns någon kontraindikation för användning av Harvoni under graviditet, finns det få kliniska data från människa. Djurstudier avseende användning av både ledipasvir och sofosbuvir har dock inte visat någon effekt på fostrets utveckling. Specialkonsultation rekommenderas under graviditeten för att bedöma hur brådskande behandlingen med Harvoni är, särskilt om man ska börja omedelbart eller vänta till efter förlossningen.
Det rekommenderas att alla kvinnor i fertil ålder övervakas varje månad för graviditet under behandlingen. Det rekommenderas också att patienten och hennes manliga partner ges åtminstone två icke-hormonella preventivmetoder och att de används under behandlingen och i sex månader därefter.
Diskussionshandbok för läkare med hepatit C
Få vår utskrivbara guide för din nästa läkarmöte för att hjälpa dig att ställa rätt frågor.

- Dela med sig
- Flip
- E-post
- Text